
МЕТОД АНАЛИЗА КОРРЕЛЯЦИОННОЙ
СИНХРОННОСТИ ЭЭГ И ЕГО ВОЗМОЖНОСТИ
г
Кулаичев А.П.
ссылки при цитировании:
Журнал высшей нервной деятельности. 2011. 61(4): 485-498

Аннотация:
Рассматривается новый методический подход
к оценке синхронности ЭЭГ, основанный на анализе корреляционных связей
между амплитудно-модуляционными процессами (огибающими ЭЭГ). Продемонстрирована
эффективность данного подхода для выявления топографических паттернов;
для анализа по частотным диапазонам; для оценки стабильности и динамики
изменения функционального состояния; для выделения разнородных подгрупп
испытуемых и выбросов; для выявления индивидуальных и групповых различий,
различий в синхронизме одноименных пар отведений и асимметрии; для классификационного
разделения записей ЭЭГ нормы и отклонений шизофренического типа с надежностью,
приближающейся к 100%.
Ключевые слова: синхронность ЭЭГ,
корреляция Пирсона, амплитудная модуляция, огибающая, фильтрация, частотные
диапазоны, топографический паттерн, про-филь синхронности, функциональное
состояние, индивидуальные и групповые разли-чия, межполушарное доминирование,
факторный анализ, дискриминантный анализ, шизофрения.
The Method of Correlation Analysis of EEG Synchronism
and its Possibilities
A.P. Kulaichev
Abstract: The
new method for estimation of EEG synchronism, based on analysis of correlation
between amplitude modulation processes (envelopes), is considered. The
efficiency of given method is shown in different aspects: for detection
of topographical pattern, for analysis on frequency domains, for estimation
of stability of functional state and its changes, for detection of heterogeneous
subgroup of examiners and outliers, for analysis of individual and group
distinctions and distinctions in synchronism between pairs of leads and
its asymmetry, for classifying division of the psychical norm from the
deviations of schizophrenic spectrum with reliability approaching to 100
%.
Key words: EEG synchronism, Pearson correlation,
amplitude modulation, envelope, fil-tration, frequency domain, topographical
pattern, profile of synchronism, functional state, individual and group
distinctions, interhemispheric dominance, factor analysis, discrimi-nant
analysis, schizophrenia.

В докомпьютерную эпоху для оценки синхронности ЭЭГ-процессов нередко использовалась
кросскорреляционная функция [15, 20], что восходит к предложению Н. Винера
(1936 г.), рассматривавшего ЭЭГ как стационарный волновой процесс. Тогда
же анализировались и корреляции нативной ЭЭГ с нулевым временным сдвигом
[2, 10] преимущественно для оценки синхронности на коротких временных отрезках
от 0.1 до 4 с с последующим изучением временной динамики таких корреляционных
связей или их усреднением [11]. С развитием микропроцессорной техники и
реализаций быстрого преобразования Фурье (БПФ) это направление в значительной
степени было вытеснено когерентным анализом [27, 34].
Поскольку главным метрологическим недостатком функции когерентности является
ее подверженность влиянию многих случайных факторов, инструментальных погрешностей
и регулировочных параметров [9, 24]*1),
то предпринимались и предпринимаются попытки разработки более устойчивых
оценок (см. обзоры [24, 25, 34, 35]), в частности с использованием
различных методов сегментации ЭЭГ (см. обзор [4]) и с поиском критериев
синхронности таких сегментных структур [5]. Задача настоящей работы также
состоит в формулировке и апробации нового метода оценки синхронности ЭЭГ.
1. ОСНОВЫ МЕТОДИЧЕСКОГО ПОДХОДА
Предыстория.
Пять лет назад нами была реализована довольно широкая программа экспериментирования
с различными алгоритмическими модификациями (в частности, [8, с. 227-230,
251-254]) упомянутого сегментационного подхода [5], в ходе которой был
получен ряд перспективных результатов. Однако эти предварительные результаты
не обладали, по нашему мнению, достаточно убедительной стабильностью в
плане межиндивидуальной и межгрупповой вариабельности. Было сделано предположение,
что эта вариабельность является следствием редуцирования исходной информации
и привнесения случайных факторов в результате сегментирования ЭЭГ, регулируемого
четырьмя-пятью установочными параметрами. Поэтому было принято решение
отказаться от собственно сегментирования, а для оценки синхронности модуляционной
динамики ЭЭГ-сигналов в их общей временной протяженности использовать коэффициент
корреляции Пирсона.
Начальные этапы. В результате сформировался методический подход, который
можно обозначить как анализ корреляционной синхронности ЭЭГ (АКС) и который
включает три начальных этапа.
1. Фильтрация ЭЭГ-сигнала в выбранном частотном диапазоне (стандартном,
усеченном или расширенном), поскольку любой анализ ЭЭГ обычно выполняется
не по всей доступный полосе, а раздельно по частотным диапазонам. Здесь
представляется целесообразным использовать Фурье- или БПФ-фильтрацию [8,
с. 220-221], поскольку этот метод (в отличие от традиционных алгоритмов
цифровой фильтрации [8, с. 217-220]) обеспечивает минимальные амплитудные
искажения при максимальной крутизне среза амплитудно-частотной характеристики
фильтра и отсутствие фазовых искажений в отфильтрованных сигналах. Последнее
особо актуально для корректности результатов последующего корреляционного
анализа и сравнимости результатов.
2. Вычисление огибающей [8, с. 221-223] от отфильтрованных ЭЭГ-сигналов,
которая прямо отображает амплитудную модуляцию ЭЭГ, фигурально говоря “огибая”
позитивные и инвертированные негативные колебания сигнала (рис. 1)
*2)
.
3. Оценка ЭЭГ-синхронизма по коэффициентам корреляции Пирсона между огибающими
в сравниваемых парах отведений *3).
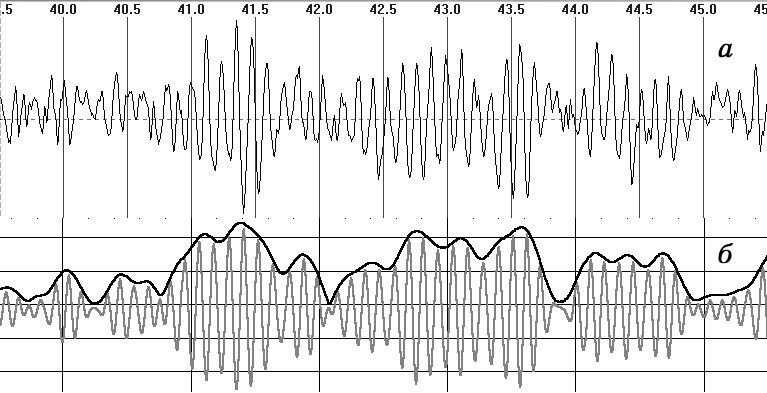
Рис. 1. Огибающая: а — ЭЭГ-сигнал с высоким содержанием
альфа-ритма; б — результат фильтрации в альфа-диапазоне с наложенной
огибающей.
Преимущества.
Отметим, что немаловажными преимуществами начальных этапов данного метода
является их концептуальная прозрачность, простота реализации, отсутствие
регулировочных параметров, нечувствительность к нарушению непрерывности
записи вследствие удаления артефактов (произведенного после этапа 1), близкая
к линейной зависимость коэффициента корреляции от уровня шума (асинхронности)
[9], возможность анализа на сравнительно коротких временных эпохах (2-4
с) *4)
.
Физиологическая
основа. Кроме того, корреляция огибающих
(в отличие от когерентности) имеет прямую и четкую физиологическую интерпретацию.
Сама огибающая в рафинированном виде выражает динамику изменения амплитудной
модуляции или амплитуды колебаний ЭЭГ, которая в свою очередь суммированно
отражает степень синхронности изменения элементарных корковых потенциалов,
будь то постсинаптические потенциалы или потенциалы какой-либо иной природы.
Поэтому корреляция огибающих отражает степень временной синхронности в
изменении такого суммарного нейронного синхронизма в двух отведениях ЭЭГ.
Предварительные
результаты. Уже первые серии расчетов
показали, что между огибающими близко расположенных (соседних) отведений
более чем в 42% случаев имеют место высокие корреляционные связи от 0.6
до 0.99 при медиане, равной 0.42, в то время как для более далеко отстоящих
отведений 98.5% корреляций огибающих не превышают 0.6 при медиане 0.17
(объем выборок 1404 и 1715 значений) *5)
. При этом отрицательные корреляции между огибающими близлежащих отведений
пренебрежимо малы как по процентному содержанию (менее 0.4%), так и по
абсолютной величине (менее 0.14). Примечательно, что такие соотношения
имеют место на протяженных временных интервалах (1 мин), включающих несколько
сотен колебаний огибающей, на первый взгляд нерегулярной и не совпадающей
периодичности. При этом высококоррелированные связи между огибающими образуют
на скальпе отчетливые топографические паттерны, далекие от случайного распределения
таких связей, которые во многом сохраняются и в соседних частотных диапазонах
ЭЭГ.
Расширения
метода. Эти результаты позволяют в настоящем
исследовании существенно сократить объем значимой информации, ограничившись
только сеткой связей между близлежащими парами отведений: для схемы 10-20%
таких пар будет 43 (рис. 2, а).
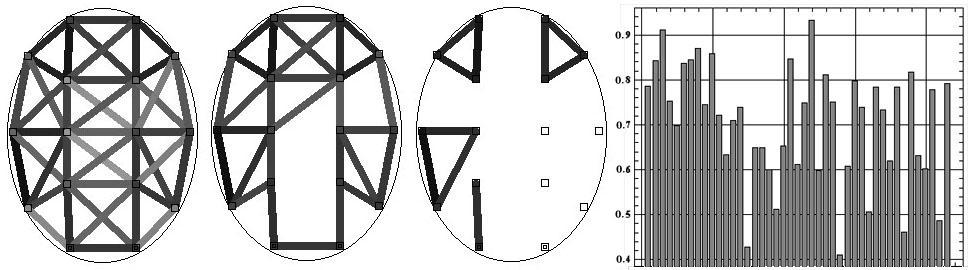
Рис. 2. Три топограммы ЭЭГ-синхронизма одного
испытуемого для стандартной сетки отведений в зависимости от величины коэффициентов
корреляции rxy (а — rxy>0.2; б — rxy>0.6; в — rxy>0.8); г — профиль синхронизма:
по вертикали — значения коэффициентов корреляции; по горизонтали — близлежащие
пары отведений, упорядоченные слева направо и сверху вниз по расположению
на скальпе.
Использование такой стандартной сетки, в частности, способствует сравнимости
результатов, получаемых разными исследователями. В рамках такой сетки легко
визуализировать высококоррелированные связи между огибающими (рис. 2, а-в),
получая хорошо визуально детектируемые топографические паттерны.
Последовательность коэффициентов корреляции между огибающими ЭЭГ для пар
отведений в их упорядоченной последовательности в такой стандартной сетке
(слева-направо и сверху-вниз) в дальнейшем будем называть профилем синхронизма
(ПС) испытуемого и его удобно изобразить в форме столбиковой диаграммы
(рис. 2, г), предоставляющей исследователю дополнительный визуальный паттерн.
Именно такие профили и являются исходным материалом в дальнейших направлениях
анализа.
В случае группы испытуемых мы будем иметь матрицу ПС (рис. 3): столбцы
— пары отведений из стандартной сетки, строки — испытуемые. Такие матрицы
могут быть получены: 1) для разных временных интервалов одного функционального
состояния; 2) для разных функциональных состояний; 3) для разных частотных
диапазонов; 4) для разных групп испытуемых, различающихся по тем или иным
признакам и т.п.
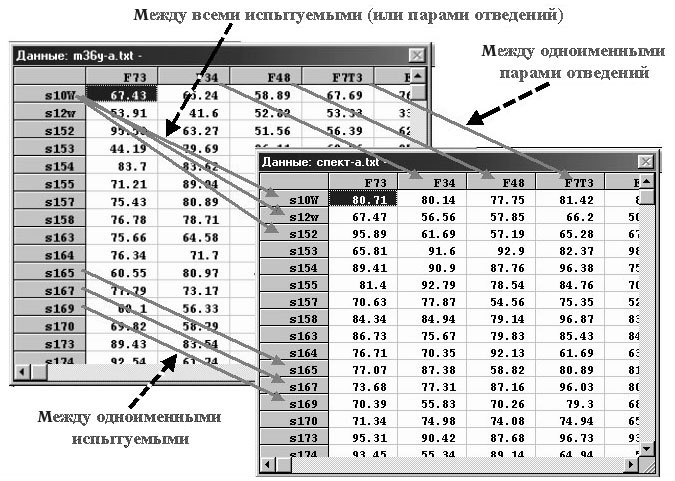
Рис. 3. Пример двух матриц профилей синхронизма
для двух различных групп испытуемых и три варианта их сравнения.
Такие матрицы в дальнейших направлениях анализа могут быть попарно сравниваемы
(рис. 3): 1) по одноименным парам отведений (по столбцам); 2) по одноименным
испытуемым (по строкам); 3) по всем испытуемым каждый с каждым; 4) по парам
отведений каждая с каждой. Такие сравнения могут осуществляться также с
использованием коэффициентов корреляции (которые будем называть вторичными
корреляциями), выступающих в качестве оценок топографической согласованности
ЭЭГ-синхронизма или близости пространственного распределения высоко- и
низкокоррелированных связей между огибающими.
Аналоги.
Отметим, что отдельные элементы данного подхода далеко не новы и сейчас
активно востребованы. Так, корреляции между нативными ЭЭГ исследовались
в работах [3, 14, 21, 22, 27, 29, 35]. Определение матриц взаимных корреляций
фигурирует в анализе глобальной корреляционной размерности ЭЭГ [18], а
аналоги вышеупомянутых вторичных корреляций — в работах [3, 22]. Огибающая
ЭЭГ использовалась: при анализе низкочастотных компонентов ЭЭГ [12], при
изучении моторных вызванных потенциалов [19], для сегментации ЭЭГ [5],
а корреляции огибающих — при исследовании в гамма-диапазоне быстротечных
изменений, связанных с событиями [25]. Широко используется и Фурье-фильтрация,
включенная в фундаментальные учебники по физике, радио и электротехнике,
электрофизиологии.
Демонстрационные
записи. Ниже возможности АКС демонстрируются
на одном общем примере записей: функциональная проба “закрытые глаза”,
две группы школьников в возрасте 10-14 лет: 39 мальчиков без психических
отклонений (группа норма) и 45 мальчиков, страдающих расстройствами шизофренического
типа (категории F20, F21, F25 по МБК-10), диагностированными специалистами
ГУ НЦПЗ РАМН (группа патология). ЭЭГ-записи выполнены по схеме 10-20% (без
фронтальных отведений Fp1, Fp2, референт A1+A2) на интервале 1 мин с частотой
дискретизации 200 Гц и не содержали артефактов. Эти записи ранее уже были
использованы в ряде публикаций, включая работы [1, 6].
Данные
литературы. Отметим, что топографические
различия ЭЭГ-синхронизма в норме и при шизофрении (при релаксации) мало
исследованы (см. обзор [13]). Результаты немногочисленных работ фрагментарны
и противоречивы. Наш литературный поиск показал, что при шизофрении по
сравнению с нормой когерентность: 1) или ниже, при этом или внутри- и межполушарная
во всех диапазонах [16], или нарушаются левополушарные F-T связи [32],
или в дельта- и тета-диапазонах в Fp1-F7 и в F7-F3 и в альфа-диапазоне
в F7-F3 [36]; 2) или выше, при этом или внутри и межполушарная в тета-диапазоне
и межполушарная в альфа-диапазоне [30], или в дельта- и бета-диапазонах
в О1-О2 и в дельта-диапазоне в Т5-Т6 [31], или внутриполушарная в дельта-диапазоне
[37]. Такая противоречивость делает особо актуальными комплексные исследования
в данной области.
Далее излагается
методология дальнейшего анализа полученных результатов *6)
в четырех представляющихся важными направлениях, рассмотренных ниже в разделах
2-5. С другой стороны, этот материал является примером комплексного системного
исследования, методология которого подробно изложена и иллюстрирована в
работе [7].
2. СРАВНЕНИЕ ПО ЧАСТОТНЫМ ДИАПАЗОНАМ
Методика.
Здесь мы исследуем различия ЭЭГ-синхронизма в разных частотных диапазонах
ЭЭГ. Данные для последующего анализа представлены в четырех матрицах ПС,
полученных для четырех стандартных частотных диапазонов: дельта, тета,
альфа, бета1. Затем вычислим коэффициенты корреляции rjj между ПС каждого
j-того испытуемого (построчно, рис. 3) в соседних частотных диапазонах:
дельта-тета, тета-альфа, альфа-бета1. Далее для полученных rjj вычислим
показатели описательной статистики (верхняя половина табл. 1).
Таблица 1. Корреляции между профилями ЭЭГ-синхронизма
и по одноименным парам отведений, вычисленные для соседних частотных диапазонов
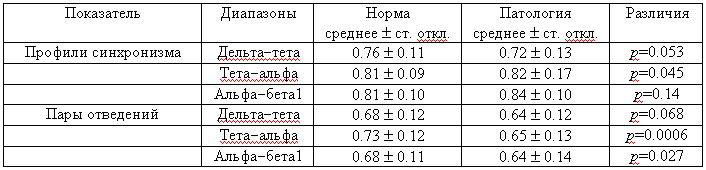 Результаты.
Видно, что между ПС испытуемых в соседних частотных диапазонах имеют место
высокие (в среднем) корреляции при сравнительно малых стандартных отклонениях
(малой вариативности средних). Из этого следует, что топографическое распределение
высоко- и низкосинхронных связей в общих чертах проявляется единообразно
в различных частотных диапазонах. Это наблюдается в обеих группах испытуемых.
Различия (р=0.045) *7)
между группами проявляются только в паре тета-альфа-диапазонов.
Результаты.
Видно, что между ПС испытуемых в соседних частотных диапазонах имеют место
высокие (в среднем) корреляции при сравнительно малых стандартных отклонениях
(малой вариативности средних). Из этого следует, что топографическое распределение
высоко- и низкосинхронных связей в общих чертах проявляется единообразно
в различных частотных диапазонах. Это наблюдается в обеих группах испытуемых.
Различия (р=0.045) *7)
между группами проявляются только в паре тета-альфа-диапазонов.
Повторим такой же анализ в отношении одноименных i-тых пар отведений (корреляции
rii между столбцами, рис. 3). Средние оценки (нижняя половина табл. 1)
оказываются немного ниже с межгрупповыми различиями по тета-альфа- и альфа-бета1-диапазонам.
Обращает также на себя внимание, что в группе норма средние корреляции
rii систематически выше (выше междиапазонное сходство): двухфакторный дисперсионный
анализ (три пары диапазонов — две группы) выявляет влияние фактора группы
на уровне значимости р=0.002.
Тем самым использование вторичных корреляций по парам отведений, а не по
профилям синхронизма, позволяет выявить определенную междиапазонную нестабильность
корреляций у испытуемых в одинаковых парах отведений *8),
более выраженную в группе патология.
3. АНАЛИЗ ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ
Методика.
Стабильность функционального состояния (в данном случае — релаксации) и
динамику его изменения можно оценить по корреляциям между ПС, полученным
на различных временных отрезках. Для оценки стабильности релаксации разобьем
1-минутную запись на два 30-секундных отрезка, для которых вычислим две
матрицы ПС. Как и выше, вычислим вторичные корреляции rjj между ПС каждого
j-того испытуемого в этих двух матрицах.
Результаты.
В табл. 2 приведены статистические оценки распределений rjj по группам
норма и патология. Эти оценки свидетельствуют о высокой и близкой временной
стабильности функционального состояния испытуемых в обеих группах при отсутствии
значимых межгрупповых различий. Анализ вторичных корреляций по одноименным
i-тым парам отведений rii (как и в предыдущем разделе) выявляет межгрупповое
различие с высокой достоверностью p<0.00005 и с более высоким средним
значением в группе норма.
Таблица 2. Корреляции между профилями ЭЭГ-синхронизма
и по одноименным парам отведений, вычисленные для двух соседних временных
интервалов ЭЭГ для альфа-диапазона
 Тем
самым ПС испытуемых в группе патология менее стабильны по rii как по частотным
диапазонам, так и во времени. Это может быть следствием большей способности
к сосредоточению на внешних установках (в данном случае — на стабилизации
функционального состояния) в группе норма.
4. ОЦЕНКА ИНДИВИДУАЛЬНЫХ РАЗЛИЧИЙ
Методика.
В продолжение анализа может представлять интерес дифференциация испытуемых
по степени стабильности функционального состояния (в частности, это важно,
если стабильность функционального состояния существенна для корректности
физиологических выводов). В этом плане по коэффициентам корреляции rjj,
полученным в предыдущем разделе, можно производить межиндивидуальные сравнения
и ранжирование испытуемых.
Тем
самым ПС испытуемых в группе патология менее стабильны по rii как по частотным
диапазонам, так и во времени. Это может быть следствием большей способности
к сосредоточению на внешних установках (в данном случае — на стабилизации
функционального состояния) в группе норма.
4. ОЦЕНКА ИНДИВИДУАЛЬНЫХ РАЗЛИЧИЙ
Методика.
В продолжение анализа может представлять интерес дифференциация испытуемых
по степени стабильности функционального состояния (в частности, это важно,
если стабильность функционального состояния существенна для корректности
физиологических выводов). В этом плане по коэффициентам корреляции rjj,
полученным в предыдущем разделе, можно производить межиндивидуальные сравнения
и ранжирование испытуемых.
В другом направлении можно исследовать парные корреляции rjk между ПС всех
j,k-испытуемых на заданном временном интервале. Тогда мы получаем квадратную
матрицу корреляций |rjk|. Одним из возможных последующих шагов может быть
вычисление по этой матрице для каждого j-того испытуемого среднего значения
Mj(rjk) от его коэффициентов корреляции с другими (k-тыми) испытуемыми.
В результате получаем, что группа патология имеет более высокое значение
Mj(rjk)=0.505-0.12 по сравнению с группой норма Mj(rjk)= 0.397-0.084 с
их различием на уровне значимости p<0.00005. Тем самым выборка из менее
представительной генеральной совокупности, относящейся к определенному
виду патологии, оказывается более корреляционно согласованной (по профилям
синхронизма), чем выборка из намного более широкой совокупности, относящейся
к психологической норме (каждый “здоров” по своему, а “больные” больны
одинаково).
Методика.
Следующим важным шагом является изучение выборочных распределений Mj(rjk),
графики которых (вариационные ряды или графики Кетле) приведены на рис.
4.
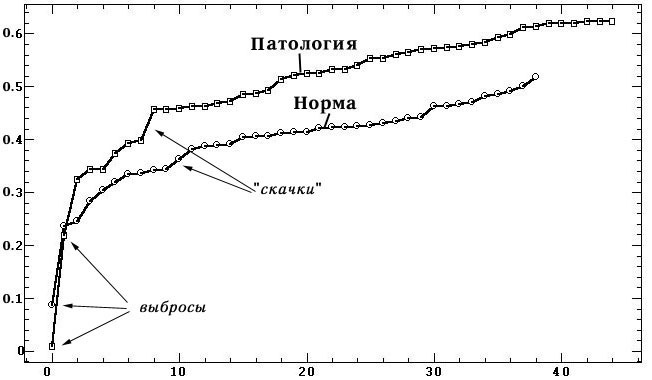
Рис. 4. Графики распределения средних корреляций
между профилями ЭЭГ-синхронизма альфа-диапазона в двух группах испытуемых;
по вертикали — значения коэффициентов корреляции; по горизонтали — испытуемые,
упорядоченные по возрастанию средних корреляций
На этих графиках обнаруживается наличие испытуемых-выбросов с низкой средней
коррелированностью: один испытуемый в группе норма с M(rjk)=0.089 и два
испытуемых в группе патология с M(rjk)=0.01 и M(rjk)=0.22. Также на этих
графиках наблюдаются неравномерности в распределениях или скачки: при M(rjk)=0.36
в группе норма и при M(rjk)-0.44 в группе патология, что может свидетельствовать
о наличии двух разнородных подгрупп испытуемых. По крайней мере можно выделить
более корреляционно согласованные и более представительные подгруппы, включающие
29 детей в группе норма и 37 детей в группе патология.
Выявленные неравномерности могут быть следствием неконтролируемых особенностей
текущего функционального и психического состояния. Поэтому перед дальнейшим
анализом выбросы обычно удаляют или корректируют, предполагая действие
неизвестных посторонних факторов *9).
Часто бывает полезно вернуться к предметному исследованию такого рода случаев,
чтобы выявить и ликвидировать недостатки и пробелы в методике проведения
экспериментов. Также, исходя из целей дальнейшего анализа, бывает целесообразно
ограничить выборку только однородными подгруппами испытуемых (см. ниже
в разделе 5.3).
Тем самым визуальное исследование графиков распределения Mj(rjk) дает важную
первичную, но чисто качественную информацию, которую далее можно статистически
верифицировать. Проведем анализ трех выявленных выбросов на их отклонение
от
среднего и получим стандартные отклонения 3.7, 2.4, 4.1, что соответствует
низкой вероятности их случайного появления р=0.0001, 0.008, 0.00001 в имеющихся
выборках из 39 и 41 детей. Далее сравним различия двух пар визуально выделенных
подгрупп испытуемых. Нулевые гипотезы и здесь не принимаются с уровнем
значимости р=0.0014, 0.00005.
Методические
продолжения. Дальнейшая дифференциация
испытуемых на подгруппы и статистическая верификация такой дифференциации
может быть осуществлена с использованием кластерного и дискриминантного
анализа, обсуждаемых ниже.
5. АНАЛИЗ ГРУППОВЫХ РАЗЛИЧИЙ
Здесь
может быть также несколько собственных методических направлений.
5.1. Оценка различий между парами отведений
На
рис. 5,а представлены связи между отведениями со значимыми различиями в
ЭЭГ-синхронизме между двумя группами детей. Они образуют отчетливый топографический
паттерн, в котором обращает на себя внимание следующее: 1) ЭЭГ-синхронизм
в группе норма в целом выше, чем в группе патология, и это относится ко
всем близлежащим межполушарным и височным связям между отведениями;
2) ЭЭГ-синхронизм в группе патология превалирует лишь в трех случаях, включая
обе височно-затылочные связи; 3) имеет место систематическое снижение средних
оценок синхронности от лобных межполушарных связей к затылочным в обеих
группах с более высокими оценками для группы норма: F3-F4: 0.70>0.63, C3-C4:
0.57>0.50, P3-P4: 0.47>0.39, O1-O2: 0.45>0.35; двухфакторный дисперсионный
анализ с использованием модели фиксированных эффектов при повторных измерениях
[7, с. 186-192] выявляет в этом случае влияние фактора отведения и фактора
группы с высокой достоверностью p<5*10-10.
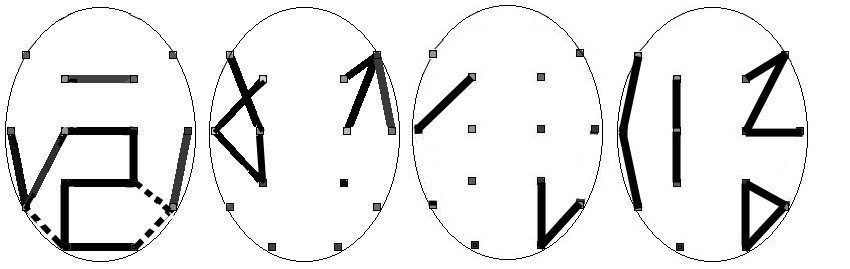
Рис. 5. Различия в ЭЭГ-синхронности альфа-диапазона
между двумя группами испытуемых: а — есть различия между одноименными парами
отведений на уровне значимости р<0.05 (сплошные линии — синхронность
больше в группе норма, пунктирные — синхронность больше в группе патология);
б — нет различий на уровне значимости р>0.6; в — различия между симметричными
парами отведений (показаны доминирующие пары) в группе норма; г — различия
между симметричными парами отведений в группе патология
Эти результаты частично подтверждают и дополняют некоторые выводы работ
[1, 16]. Кроме того, такую же закономерность последовательного снижения
межполушарной синхронности от лба к затылку нам удалось выявить и при исследовании
стадии предзасыпания (W-стадия) у группы взрослых испытуемых существенно
отличной этнической группы (японцы), хотя в других стадиях сна закономерности
были иными. Это показывает, что метод АКС обладает хорошей чувствительностью
и устойчивостью, чтобы выявлять одинаковые закономерности на совершенно
разном экспериментальном материале.
Отсутствие
различий. Корреляционные связи, для которых
с высокой достоверностью не обнаружено межгрупповых различий (рис. 5, б),
также образуют отчетливый топографический паттерн, включающий преимущественно
внутриполушарные связи между лобными, центральными и височными отведениями,
что может явиться предметом отдельного изучения.
Полушарное
доминирование. Выявим статистически значимые
различия между симметричными связями, раздельно внутри каждой из двух групп
испытуемых. Для группы норма полушарное доминирование выражено достаточно
слабо (рис. 5, в), а для группы патология оно более широко распространено
(рис. 5, г) и включает левополушарные парасагиттальные связи и правополушарные
преимущественно аксиальные связи. Общий для групп характер асимметрии наблюдается
в затылочной области.
5.2. Факторный анализ
Метод
главных компонент. Раздельный факторный
анализ матриц ПС двух групп испытуемых выявил сильную и по числовым соотношениям
близкую факторную структуру: из 36 анализируемых корреляционных связей
(исходные переменные в факторном анализе) выделяются четыре первых главных
компонента (фактора), покрывающих 66-67% общей дисперсии. Тем самым между
этими переменными в свою очередь имеют место многочисленные и сильные корреляционные
взаимосвязи. Дисперсия по этим факторам распределяется в следующих, близких
для двух групп соотношениях: 26.5-19.84-11.5-8.6% для группы норма; 31.2-16-11.6-8.4%
для группы патология.
В распределении же факторных нагрузок исходных переменных наблюдаются существенные
различия. Так для высоких факторных нагрузок на первый фактор (нагрузки
> 0.6) для группы норма наблюдается топографический паттерн (рис. 6, а),
распространенный в аксиальном направлении через центральные, теменные и
височные отведения, тогда как для группы патология имеет место другой паттерн,
распространенный от лба к затылку в сагиттальном направлении (рис. 6, б).
На второй фактор высокие нагрузки имеют значительно меньшее число переменных
(рис. 6, в, г), включающих: 1) связи между левыми лобными, височными
и центральными отведениями для группы норма; 2) две височные связи для
группы патология. На третий и четвертый факторы исходные переменные не
имеют высоких или преимущественных нагрузок (за исключением О1-О2 для третьего
фактора по группе норма), что исключает топографическую интерпретацию этих
факторов.
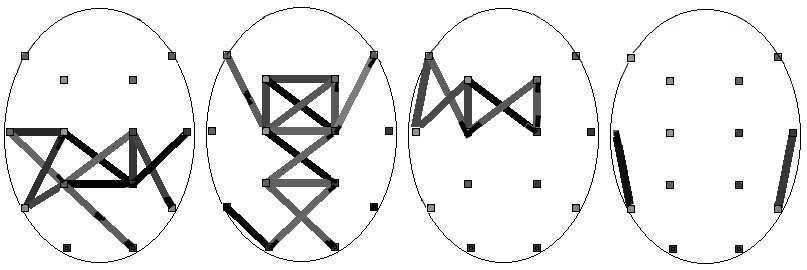
Рис. 6. Пары отведений, корреляции между огибающими
ЭЭГ которых имеют преимущественные проекции на первый (а, б) и второй (в,
г) факторы для групп норма (а, в) и патология (б, г)
Методика.
Это была преимущественно качественная характеристика различий факторных
структур двух групп испытуемых. Однако можно получить и количественную
характеристику различий. Для этого вычислим коэффициенты корреляции между
факторными нагрузками всех исходных переменных по каждому фактору для двух
групп испытуемых, и получим в порядке факторов: 1) 0.106; 2) 0.807; 3)
0.227; 4) 0.328.
Действительно, мы видим, что межгрупповые корреляции между первым, третьим,
четвертым факторами пренебрежимо малы, т. е. эти факторы для двух групп
различны и их взаимное геометрическое положение близко к ортогональному
(как это было видно и на рис. 6, а, б для первого фактора). Однако высокая
корреляция по второму фактору указывает на близкую геометрическую направленность
двух векторов второго фактора, вычисленных для двух групп испытуемых. Поэтому
фактор 2 может отражать общегрупповые физиологические закономерности, которые
могут стать предметом отдельного исследования.
5.3. Классифицирующее разделение испытуемых
на группы
Кластерный
анализ. В прикладной статистике разделение
объектов на заданное число классов в многомерном пространстве исходных
переменных можно осуществить, в частности, с помощью дивизивной стратегии
кластерного анализа [7, с. 350-365]. Однако этот метод дает стабильные
и убедительные результаты, когда распределение объектов в многомерном пространстве
переменных имеет характер компактных групп, разделенных между собой большими
расстояниями. В данном случае эти условия не выполняются, поскольку между
нормой и психической патологией нельзя предполагать существование четкой
и широкой разделяющей границы.
Кроме того, классифицирующая чувствительность метода уменьшается при увеличении
числа малоинформативных и высококоррелированных переменных. В такой ситуации
помогает предварительное выделение первоочередных факторов и проведение
кластеризации в усеченном пространстве факторных координат. Последнее осмысленно
при наличии однородной группы объектов, в которой действуют одинаковые
факторы. Однако приведенные выше результаты показывают, что в двух рассматриваемых
группах преимущественно действуют различные факторы.
Методика
дискриминантного анализа (этапы 1-3).
Поэтому для дифференциации двух групп испытуемых используем метод дискриминантной
классификации [7, с. 365-370], позволяющий статистически верифицировать
уже известную или предполагаемую классификацию объектов. Здесь мы расширим
задачу в направлении сравнения возможностей различных частотных диапазонов
в плане эффективности такой дифференциации. Для этого используем четыре
пары матриц ПС, полученных раздельно по четырем стандартным частотным диапазонам
для двух групп испытуемых, а также две матрицы для расширенного диапазона
тета-альфа-бета1.
Этап
1. Дивизивная классификация. Сначала произведем
общую классификацию испытуемых, объединяя матрицы ПС двух групп в одну
матрицу и добавляя в нее классифицирующую переменную, указывающую класс
(номер группы) каждого испытуемого.
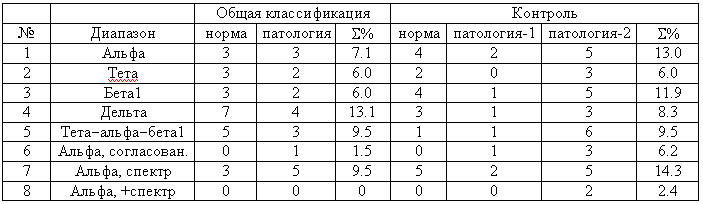
Как видно из табл. 3 (левая часть, строки
1-5) наилучшие результаты дает использование диапазонов тета, бета1, альфа
с суммарным числом ошибок (отнесение к другому классу), не превышающим
6-7.1%.
Таблица 3. Число неправильно классифицированных
испытуемых в группах норма и патология (отклонения шизофренического типа)
 Этап
2. Статистическая верификация. Далее необходимо
установить, насколько достоверно число наблюдаемых ошибок классификации
отличается от случайного. Для этого используем метод статистического моделирования
— будем повторно производить дискриминантную классификацию, каждый раз
случайно перемешивая ПС испытуемых в объединенной матрице относительно
неизменного порядка номеров классов.
Этап
2. Статистическая верификация. Далее необходимо
установить, насколько достоверно число наблюдаемых ошибок классификации
отличается от случайного. Для этого используем метод статистического моделирования
— будем повторно производить дискриминантную классификацию, каждый раз
случайно перемешивая ПС испытуемых в объединенной матрице относительно
неизменного порядка номеров классов.
В результате для 25 случайных моделирований получаем среднее число неправильно
классифицированных испытуемых 14.96 при стандартном отклонении 3.47. Число
ошибок в общей классификации (табл. 3) для диапазонов тета и бета1 составляет
5 человек, и это больше 2.58 стандартного отклонения от случайного среднего
14.96. Поскольку случайное распределение числа ошибок при моделировании
находится в хорошем соответствии с нормальным распределением (при значимости
0.18-0.29 по критериям Колмогорова, омега-квадрат и хи-квадрат), то полученное
стандартное отклонение, большее 2.58, соответствует вероятности 0.0049,
что в 10 раз ниже обычного уровня 0.05 достоверности статистических различий.
Это свидетельствует о высокой достоверности неслучайного характера результатов
дискриминантной классификации.
Этап
3. Классификация новых объектов. На третьем,
контрольном этапе анализа необходимо оценить, насколько надежно полученная
дискриминация позволяет классифицировать новые объекты. Для этого группу
патология случайным образом разобьем на две подгруппы в соотношении числа
испытуемых три к двум (патология-1 и патология-2) и для группы патология-2
в объединенной матрице укажем неопределенный класс (нулевой). Тогда классифицирующие
функции будут построены на обучающих группах норма—патология-1, и они будут
использованы для классификации группы патология-2.
Как видно из правой части табл. 3, наилучшие результаты дает использование
ПС тета-диапазона с общим числом ошибок 6% при 3-х испытуемых из 18, ошибочно
отнесенных к норме в классифицируемой выборке. Если же использовать только
высококорреляционно согласованные подгруппы испытуемых из 29 и 37 человек,
выделенные выше (рис. 4), то на примере альфа-диапазона это дает существенное
улучшение результатов (табл. 3, строка 6): 1.5% ошибок в общей классификации
и 6.2% ошибок в контрольной классификации.
Использование
спектральных оценок. В заключение оценим
дискриминантную чувствительность спектральных оценок в имеющихся 14 отведениях,
выбрав для этого статистически устойчивый показатель — среднюю амплитуду
спектра в частотном диапазоне. Амплитудные спектры вычислим на максимальном
(для БПФ по степени 2) 41-секундном интервале, что обеспечивает высокое
разрешение по частоте 0.024 Гц, а это обеспечивает хорошую статистическую
достоверность средних оценок с учетом наличия не менее 160 спектральных
гармоник в каждом частотном диапазоне. Однако амплитудный уровень ЭЭГ подвержен
значительной межиндивидуальной вариативности (в 2-3.5 раза по средним значениям),
определенной индивидуальными особенностями ЭЭГ испытуемых и инструментальными
факторами. Для ее нивелирования произведем нормировку средних амплитуд
спектра: каждое значение для конкретного испытуемого выражается в процентном
отношении к средней для него амплитуде спектра по всем отведениям и всем
частотным диапазонам *10)
.
Результаты.
Как видно из табл. 3 (строка 7), спектральные оценки по сравнению с оценками
синхронности (строка 1) на примере альфа-диапазона менее предпочтительны,
поскольку ухудшают результаты как в общей, так и в контрольной классификациях.
Если же объединить эти два вида оценок в одну матрицу, то получаем результат,
приближающийся к идеальному (табл. 3, строка 8): 100%-ная надежность общей
классификации и 2.4% ошибок в контрольной классификации. Приведенные результаты
значительно лучше большинства других, использующих более сложные подходы
к классификации нормы и шизофрении, где число ошибок составляет *11):
23% [39], 12.5% [23], 5.5—13.5% [28], 25—28.2% [33]. Кроме того, важная
статистическая верификация результатов классификации (обозначенная здесь
как этапы 2, 3 анализа) ни в одной из аналогичных работ не производится,
без чего никакой метод классификации не может считаться достаточно обоснованным,
эффективным и универсальным.
6. СРАВНЕНИЕ РАЗЛИЧНЫХ ИСХОДНЫХ ПОКАЗАТЕЛЕЙ
Методика.
Профили и матрицы ЭЭГ-синхронизма могут быть построены с использованием
разных исходных показателей: на основе корреляций между: 1) огибающими
ЭЭГ; 2) нативными ЭЭГ, отфильтрованными в заданном частотном диапазоне;
3,4) участками амплитудных (комодуляция [35]) и фазовых спектров; а также
с использованием оценок: 5) когерентности; 6) межсегментной синхронности
[5].
В качестве первого шага оценим, насколько различаются ПС, полученные с
использованием этих шести показателей. Для этого вычислим шесть матриц
ПС *12)
для альфа-диапазона. Затем для каждого из 84 испытуемых вычислим пять коэффициентов
корреляции между его ПС на основе огибающей и его же профилями синхронизма,
построенными с использованием других показателей, получив матрицу 5-84,
а затем вычислим средние значения по пяти столбцам.
Результаты.
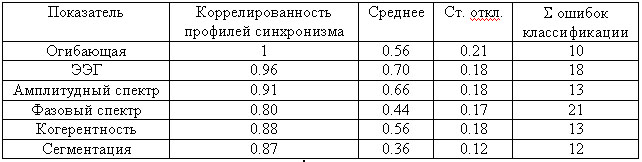
Высокие оценки полученных средних корреляций (табл. 4, столбец 1) свидетельствуют
о том, что топография ЭЭГ-синхронизма в близких соотношениях отражается
различными оценочными показателями. Особенно это выражено для нативной
ЭЭГ как наиболее близкого к огибающей показателя.
Таблица 4. Сравнение исходных показателей
ЭЭГ-синхронизма
 Методика.
В связи с этим следующей задачей является выбор наиболее эффективного и
чувствительного из рассмотренных показателей. Вычислим средние значения
и стандартные отклонения для элементов (их число 36*84=3024) каждой из
шести матриц ПС.
Методика.
В связи с этим следующей задачей является выбор наиболее эффективного и
чувствительного из рассмотренных показателей. Вычислим средние значения
и стандартные отклонения для элементов (их число 36*84=3024) каждой из
шести матриц ПС.
Результаты.
Видно, что огибающая по своему среднему значению (табл. 4, столбец 2) выгодно
отличается лучшим центрированием относительно диапазона значений 0-1. Тем
самым распределение ее значений более симметрично, тогда как распределения
значений других показателей значительно смещены в область низких или высоких
оценок. Далее обращает на себя внимание, что огибающая отличается
наибольшим стандартным отклонением. Тем самым ее значения более равномерно
распределены по всему диапазону, тогда как значения других показателей
более сконцентрированы вблизи среднего. Обе эти характеристики свидетельствуют
о большей избирательной чувствительности огибающей в оценке вариативности
ЭЭГ-синхронизма.
Методика.
Наконец, сравним чувствительность различных показателей на задаче классификации
двух групп испытуемых.
Результаты.
В последнем столбце табл. 4 указано суммарное число ошибок в общей и контрольной
классификациях с использованием наиболее “эффективного” для решения этой
задачи тета-диапазона (он оказался “лучшим” для всех перечисленных показателей).
Как видно, использование огибающей дает меньше всего ошибок при дискриминантной
классификации двух групп испытуемых. Тем самым и в данном аспекте этот
показатель является наиболее предпочтительным.
ЗАКЛЮЧЕНИЕ
В рамках
предварительного (пилотного) исследования возможностей метода АКС (анализ
корреляционной синхронности) для оценки ЭЭГ-синхронизма на примере дифференциации
групп норма и патология (отклонения шизофренического типа) получены следующие
значимые результаты:
1) высокие корреляции между близкими отведениями
и малые между далекими;
2) многочисленные топографические паттерны,
далекие от случайного распределения;
3) близость топографических паттернов в соседних
частотных диапазонах;
4) более высокая стабильность функционального
состояния в группе норма;
5) более высокая межиндивидуальная согласованность
группы патология;
6) выделение подгрупп и выбросов среди испытуемых
по оценкам межиндивидуальной согласованности;
7) различие пар отведений с высокой ЭЭГ-синхронностью
в двух группах испытуемых;
8) более высокий ЭЭГ-синхронизм в группе норма;
9) последовательное снижение синхронности
от лобных межполушарных связей к затылочным в обеих группах;
10) различие топографии полушарного доминирования
с более широким его пространственным представительством в группе патология;
11) сильная факторная структура для 36 анализируемых
корреляционных связей в обеих группах с превалированием четырех главных
факторов;
12) качественное и количественное различие
факторов, действующих в двух группах;
13) высокодостоверное дискриминантное разделение
записей ЭЭГ нормы и шизофрении с надежностью, приближающейся к 100%;
14) большая чувствительность предложенной
оценки ЭЭГ-синхронизма по сравнению с другими показателями.
Эти многочисленные и многоплановые результаты свидетельствуют о физиологической
валидности, инновационной эффективности, плодотворности и перспективности
предлагаемого подхода.
СПИСОК ЛИТЕРАТУРЫ
-
1. Борисов С.В., Каплан А.Я., Горбачевская Н.Л.,
Козлова И.А. Анализ структурной синхронности ЭЭГ подростков, страдающих
расстройствами шизофренического спектра. Физиология человека. 2005. 31(3):
1-8.
-
2. Иваницкий А.М., Стрелец В.Б. Функциональные
связи различных отделов коры больших полушарий при восприятии внешних раздражителей.
Журн. высш. нерв. деят. 1979. 29(6): 10-71.
-
3. Ивонин А.А., Цицерошин М.Н., Погосян А.А.,
Шуваев В.Т. Генетическая обусловленность нейрофизиологических механизмов
корково*подкорковой интеграции биоэлектрической активности мозга. Рос.
физиол. журн. 2002. 88(10): 1330-1342.
-
4. Каплан А.Я. Проблема сегментного описания электроэнцефалограммы
человека. Физиология человека. 1999. 25(1): 125-133.
-
5. Каплан А.Я., Борисов С.В., Шишкин С.Л., Ермолаев
В.А. Анализ сегментной структуры альфа-активности ЭЭГ человека. Рос. физиол.
журн. 2002. 4: 84-95.
-
6. Каплан А.Я., Борисов С.В., Желиговский В.А.
Классификация ЭЭГ подростков по спектральным и сегментным характеристикам
в норме и при расстройстве шизофренического спектра. Журн. высш. нерв.
деят. 2005. 55(4): 450-458.
-
7. Кулаичев А.П. Методы и средства комплексного
анализа данных. Учебное пособие для классического университетского образования.
М.: ФОРУМ—ИНФРА-М, 2006. 512 с.
-
8. Кулаичев А.П. Компьютерная электрофизиология
и функциональная диагностика. Учебное пособие для классического университетского
образования. М.: ФОРУМ—ИНФРА-М, 2007. 640 с.
-
9. Кулаичев А.П. Об информативности когерентного
анализа в исследованиях ЭЭГ. Журн. высш. нерв. деят. 2009. 59(6): 766-775.
-
10. Ливанов М.Н., Гаврилова Н.А., Асланов А.С.
Взаимные корреляции между различными участками коры головного мозга при
умственной работе. Журн. высш. нерв. деят. 1964. 14(2): 185-194.
-
11. Ливанов М.Н. Пространственная организация
процессов головного мозга. М.: Наука, 1972. 182 с.
-
12. Машеров Е.Л. Происхождение низкочастотной
компоненты биопотенциалов мозга. Цит. по: Иванов Л.Б. Прикладная компьютерная
электроэнцефалография. М.: НМФ “МБН”, 2000: 187-196.
-
13. Мельникова Т.С., Лапин И.А., Сиркосян В.В.
Обзор использования когерентного анализа в психиатрии. Соц. и клин. психиатрия.
2009. 19(1): 90-94.
-
14. Николаев А.Р., Иваницкий Г.А., Иваницкий А.М.
Новый метод исследования корковых взаимодействий в коротких интервалах
времени при поиске вербальных ассоциаций. Журн. высш. нерв. деят. 2000.
50(1): 44-61.
-
15. Русинов В.С., Гриндель О.М., Болдырева Г.Н.,
Вакар Е.М. Биопотенциалы мозга человека. М.: Медицина, 1987. 256 с.
-
16. Стрелец В.Б., Гарах Ж.В., Новотоцкий-Власов
В.Ю., Магомедов Р.А. Соотношения между мощностью и синхронизацией ритмов
ЭЭГ при когнитивной патологии. Журн. высш. нерв. деят. 2005. 55(4): 496-504.
-
17. Стрелец В.Б., Новотоцкий*Власов В.Ю., Гарах
Ж.В., Желиговский В.А., Каплан А.Я. Многопараметрический комбинаторный
анализ ритмов ЭЭГ в норме и при шизофрении. Журн. высш. нерв. деят. 2007.
57(6): 699–706.
-
18. Сулимов А.В., Марагей Р.А. Изучение ЭЭГ сна
как нелинейного динамического процесса сравнения глобальной корреляционной
размерности ЭЭГ человека и мер линейной зависимости между каналами. Журн.
высш. нерв. деят. 2003. 53(2): 151-155.
-
19. Трембач А.Б., Гутман С.Р., Корепанов А.Л.,
Пирожков О.В.. Амплитудная модуляция электроэнцефалограммы, связанная с
инициацией и прекращением движения. Биофизика. 1990. 35(5): 850-854.
-
20. Труш В.Д., Кориневский А.В. ЭВМ в нейрофизиологических
исследованиях. М.: Наука, 1978. 238 с.
-
21. Тутер Н.В., Гнездицкий В.В. Компрессионно*спектральный
анализ ЭЭГ при панических расстройствах, возникающих у пациентов с различными
психическими заболеваниями. Журн. неврологии и психиатрии. 2008. 108(3):
58-66.
-
22. Цицерошин М.Н., Бурых Э.А. Структура пространственных
когерентных соотношений потенциалов мозга в различных частотных диапазонах
ЭЭГ. Физиология человека. 1996. 22(1): 11-21.
-
23. Boostani R., Sadatnezhad K., Sabeti M. An
efficient classifier to diagnose of schizophrenia based on the EEG signals.
Exp. Syst. Appl. 2009. 36(3): 6492-6499.
-
24. Bruns A. Fourier-, Hilbert- and wavelet-based
signal analysis: are they really different approaches? J. Neurosci. Methods.
2004. 137(2):321-332.
-
25. Bruns A., Eckhorn R., Jokeit H., Ebner A.
Amplitude envelope correlation detects coupling among incoherent brain
signals. Cogn. Neurosci. 2000. 11(7): 1509-1514.
-
26. Fehr T., Wienbruch C., Moratti S., Rockstroh
B., Elbert T. Statistical discrimination of controls, schizophrenics, depressives
and alcoholics using local MEG frequency-related variables. Biomed. Techn.
2001. 46(2): 242-244.
-
27. Guevara M.A., Corsi*Cabrera M. EEG coherence
or EEG correlation? Int. J. Psychophysiol. 1996. 23(3): 145-153.
-
28. Ince N.F., Stephane M.,
Tewfik A.H., Pellizzer G., McClannahan K.
Schizophrenia classification using working memory MEG ERD/ERS patterns.
Proc. of 3rd int. IEEE/EMBS conf. on neural eng. 2007. 457-460.
-
29. Lastochkina N. A., Puchinskaya L. M. Correlation
analysis of EEG rhythms and functional asymmetry of the hemispheres in
children with the hyperdynamic syndrome. Neurosci. Behav. Physiol. 1992.
2(3): 251-258.
-
30. Merrin E.L., Floyd T.C., Fein G. EEG coherence
term in unmedicated schizophrenic patients. Biol. Psychiat. 1989. 25(1):
60-66.
-
31. Nagase, Y., Okubo, Y., Matsuura, M., Kojima
T., Torua M. EEG coherence in unmedicated schizophrenic patients: topographical
study of predominantly never medicated cases alert. Biol. Psychiat. 1992.
32(11): 1028-1034.
-
32. Norman R.M., Malla A.K, Williamson P.C., Morrison-Stewart
S.L., Helmes E., Cortese L. EEG coherence and syndromes in schizophrenia.
Br. J. Psychiatry. 1997. 170: 411-415.
-
33. Sakoglu U., Michael A.M., Calhoun V.D. Classification
of schizophrenia patients vs healthy controls with dynamic functional network
connectivity . Neuroimage. 2009. 47(1): S39-S41.
-
34. Shaw J.C. Correlation and coherence analysis
of the EEG: a selective turtorial review. Int. J. Psychophysiol.
1984. 1: 255-266.
-
35. Sterman M.B., Kaiser D.A. Comodulation: A
new QEEG analysis metric for assessment of structural and functional disorders
of the CNS. J. Neurotherapy. 2001. 4(3): 73-83.
-
36. Tauscher J., Fischer P., Neumeister A., Rappelsberger
P., Kasper S. Low frontal electroencephalographic coherence in neuroleptic-free
schizophrenic patients. Biol. Psychiatry. 1998. 44(6): 438-447.
-
37. Wada Y., Nanbu Y., Kikuchi M., Koshino Y.,
Hashimoto T. Photic stimulation in drug-naive patients. Aberrant functional
organization in schizophrenia: analysis of EEG coherence during rest. Neuropsychobiology.
1998. 38(2): 63-69.
-
38. Wiener N. Generalized harmonic analysis. Acta
Math. 1930. 55: 182-195.
-
39. Winterer G., Ziller M., Dorn H., Frick K.,
Mulert C., Wuebben Y., Herrmann W. M. Frontal dysfunction in schizophrenia
– a new electrophysiological classifier for research and clinical applications.
Eur. Arch. Psychiat. Clin. Neurosci. 2000. 250(4): 207-214.

Сноски
*1)
Сейчас уже никто не вспоминает, что развитие когерентного анализа преимущественно
было инициировано работами Н. Винера в 1928-1930 гг. [38] применительно
к задачам оптики и квантовой механики, крайне далеких от физиологии ВНД.
И только годы спустя когерентность стала эпизодически использоваться в
технических приложениях, причем в качестве сугубо второстепенного показателя
при анализе стационарных сигналов. Почему в начале 1950-х годов когерентность
стала использоваться для анализа нестационарных ЭЭГ-сигналов и вовсе не
гармонического происхождения, а затем приобрела там самостоятельное и доминирующее
положение, во многом остается науковедческим “белым пятном” [9].
*2)
Огибающая математически определена как модуль аналитического (комплекснозначного)
сигнала, действительная часть которого равна самому сигналу, а мнимая часть
получена преобразованием Гильберта, которое в свою очередь эквивалентно
двойному преобразованию Фурье, когда перед обратным преобразованием все
спектральные гармоники сдвигаются по фазе на 90 град.
*3)
Тем самым мы ограничиваемся анализом корреляций с нулевым временным сдвигом.
Действительно, поскольку латентности межнейронного и объемного проведения
потенциалов в коре составляют не более 1 мс, а периоды амплитудной модуляции
ЭЭГ - не менее 0.3*0.4 с, то учетом временных сдвигов в анализе корреляционной
синхронности огибающих ЭЭГ при частотах дискретизации до 1 кГц можно пренебречь.
*4)
При этом в стандартных частотных диапазонах будет не менее 4-8 спектральных
гармоник, что позволяет достаточно адекватно отразить амплитудную модуляцию
сигнала. Верхний же предел эпохи анализа ограничивается, по видимому (как
следует из рассмотренных ниже результатов), лишь задачей экспериментатора.
*5)
Обратно пропорциональная зависимость коэффициентов корреляции между нативными
ЭЭГ кролика от расстояния между электродами была выявлена М.Н. Ливановым
с сотр. [11]. Ряд последующих исследователей обнаружил сходные закономерности
и в отношение когерентности ЭЭГ человека.
*6) Если
не указано иное, анализ производится в альфа-диапазоне на интервале 1 мин.
*7) Поскольку
большинство рассматриваемых выборочных распределений не соответствует нормальному
закону, то везде далее парные различия (в медианах) выявляются по критерию
Вилкоксона (одно- или двухвыборочный в зависимости от типа данных).
*8) Иными
словами, возьмем два одноименных столбца Х1, Х2 (одна пара отведений)
в двух матрицах ПС (индексы 1 и 2), у одних i-тых
испытуемых оценки синхронности близки Х1(i)=Х2(i), а у других j-тых
испытуемых оценки существенно различаются Х1(j)#Х2(j).
*9) Выявление
и обработка выбросов и выделение разнородных групп является важной статистической
задачей [7, с. 74-78], которая, к сожалению, почти не учитывается в физиологических
исследованиях. Невнимание к этим вопросам может повлечь, в частности, выявление
“псевдозначимых” или “псевдонезначимых” различий в выборочных средних значениях.
*10) Было
опробовано несколько различных нормировок, из которых в дискриминационном
плане ис-пользуемая здесь нормировка показала наилучшие результаты. В частности,
данная нормировка уменьшает коэффициенты вариации амплитудных оценок испытуемых
по отведениям и частотным диапазонам в 2.2-3.5 раза.
*11) С
этим контрастируют результаты работ [6, 17, 26], заявляющие о близкой к
100% достоверности классификации, однако подходы [6, 17] обеспечивают лишь
одностороннее разделение: нормы от шизофрении, но не обратно.
*12) Амплитудные
и фазовые спектры вычислены на эпохе 41 с (разрешение по частоте 0.024
Гц) с вычислением корреляций (по парам отведений) между участками спектров
частотного диапазона (включающих более 160 спектральных составляющих).
Когерентность вычислена с усреднением 24 2.56-секундных эпох и вычислением
среднего значения в частотном диапазоне. Межсегментная синхронность оценивается
долей совпадающих сегментов.

![]()










![]()